- 텍스트 축소
- 확대
제넥신 컨소시엄 코로나19 백신 임상 식약처 승인
- 송고 2020.06.11 14:37 | 수정 2020.06.11 14:38
- EBN 동지훈 기자 (jeehoon@ebn.co.kr)
IND 제출 15일여 만…국내 기업 주도 첫 사례
시험 대상자 20명→190명으로 대폭 확대
ⓒ식품의약품안전처
코로나바이러스 감염증-19(코로나19) 예방용 백신을 개발 중인 제넥신 컨소시엄이 식품의약품안전처로부터 임상 승인을 받았다.
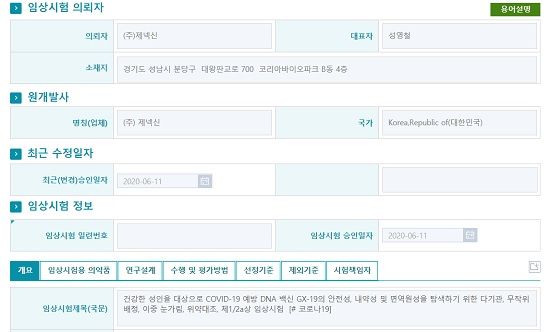
11일 관련 업계에 따르면 식품의약품안전처는 이날 제넥신 컨소시엄이 개발 중인 코로나19 백신 후보물질 'GX-19'의 임상 1/2a상을 승인했다.
컨소시엄은 △제넥신 △제넨바이오 △포스텍 △국제백신연구소 △바이넥스 △카이스트(KAIST) 등 총 6개 기업 및 기관으로 구성된다.
GX-19는 컨소시엄이 개발한 코로나19 예방용 DNA 백신으로 최근 원숭이를 대상으로 한 비임상을 마쳤다. 비임상에선 야생형 코로나19 바이러스(SARS-CoV-2)에 대항하는 중화항체가 생성됐으며, 면역반응 유도도 확인됐다.
비임상 이후 컨소시엄은 임상 시료 생산을 거쳐 식약처에 비임상 데이터가 반영된 임상 신청 자료를 제출했다.
현재 국내에서 승인받은 코로나19 백신 임상은 미국 이노비오가 유일하다. 국내 기업이 주도하는 임상 중에선 제넥신 컨소시엄의 임상 승인이 첫 사례다.
이번 임상 승인은 임상시험계획(IND)이 제출된 지 약 15일 만이다. 식약처 지원으로 임상 승인 기간이 줄어든 결과다.
앞서 식약처는 코로나19 치료제 및 백신 개발 기간을 단축하고 기업 애로사항을 줄이기 위해 'K-백신 신속심사 추진반'을 운영한다고 밝혔다. 이와 함께 '고(GO)·신속 프로그램'을 통해 코로나19 백신 및 치료제 개발을 지원한다고 발표한 바 있다.
식약처 방침에 따라 한 달여가 소요됐던 임상 승인 기간은 기존 물질을 사용할 경우 7일, 신물질을 사용하는 경우 15일로 줄어들게 됐다. 제넥신 컨소시엄의 경우 DNA 백신이라는 새로운 형태로 개발돼 IND 제출 이후 15일가량이 소요된 것이다.
임상 대상은 건강한 사람이며 목표 시험 대상자는 190명으로 정해졌다. 당초 컨소시엄이 생각했던 20명 안팎에서 대폭 늘어난 대상자다.
실시기관은 연대 세브란스병원, 강남 세브란스병원이다. 임상은 GX-19의 안전성과 내약성 및 면역원성을 탐색하기 위한 다기관, 무작위 배정, 이중 눈가림, 위약대조 방식으로 진행된다. 기간은 이달부터 오는 2022년 6월까지다.
©(주) EBN 무단전재 및 재배포 금지
관련기사
전체 댓글 0
서울미디어홀딩스
패밀리미디어 실시간 뉴스



![[특징주] 마이크로투나노, SK하이닉스 납품 소식에 ‘급등’](https://cdnimage.ebn.co.kr/news/news-p.v1.20240423.85ca4c47eb3c4f4f85df1178e6bcd9a5_T1.png)
![[특징주] HD현대일렉트릭, 어닝 서프라이즈에 급등](https://cdnimage.ebn.co.kr/news/news-p.v1.20240202.3019e6311039467197c5797c2028aa74_T1.jpg)